A retinocoroidite é a principal manifestação da toxoplasmose congênita. Ocorre entre 20% e 72% dos infectados ao nascimento e pode se desenvolver em 90% deles até a adolescência. Saiba mais sobre a doença
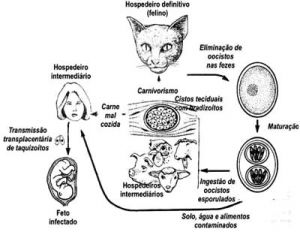
O Toxoplasma gondii é um dos parasitas mais bem-sucedidos de que se tem conhecimento, podendo infectar praticamente todo animal de sangue quente, em qualquer parte do planeta. Estima-se que a infecção pelo T. gondiiocorra em pelo menos um terço da população humana mundial, com taxas mais altas de prevalência em locais quentes e úmidos (pelo efeito favorecedor dessas condições na maturação dos oocistos depositados no solo), naqueles em que haja abundância do hospedeiro definitivo (felinos, em especial o gato doméstico), em populações com hábito de ingerir carnes cruas (contaminadas com cistos teciduais) e naquelas com condições sanitárias desfavoráveis (facilitando a ingestão de oocistos, contaminando água e alimentos) – Figura 1.
Especialmente no Brasil, a soropositividade ao T. gondii varia de 50% a 83% da população, em função das diversas condições mencionadas. Já foi demonstrado ser a água uma importante via de transmissão. Em grupos com nível socioeconômico mais baixo, a soroconversão é mais precoce.
Além da ingestão de oocistos maduros (contaminando a água, o solo e os alimentos) e de cistos teciduais (presentes em carnes mal cozidas, em especial de ovinos, suínos, caprinos, bovinos e até mesmo em aves), a toxoplasmose pode também ser transmitida através da placenta (transmissão vertical), do transplante de órgãos e, em teoria, por meio do contato íntimo com qualquer fluido corporal que possa conter o parasita (como saliva, esperma e outras secreções). Embora possível, a transmissão pelo leite materno é improvável. Não há, portanto, contra-indicação à amamentação.
Em geral, a toxoplasmose é uma doença autolimitada, passa-se de forma assintomática na grande maioria dos indivíduos imunocompetentes, mas pode ter conseqüências devastadoras principalmente em neonatos, após transmissão vertical e em imunossuprimidos, seja na primo-infecção ou mesmo na reativação da infecção latente.
Após a infecção, o T. gondii tem uma capacidade especial de interagir com o sistema imune do hospedeiro, subvertendo-o e estabelecendo infecção crônica (latente). É possível que a suscetibilidade genética do indivíduo interfira nessa interação e, portanto, na patogênese. Quando essa interação é muito precoce, como na infecção congênita, mecanismos de imunotolerância podem tornar o hospedeiro ainda mais suscetível à latência.
Ademais, alguns tipos de cepas do parasita parecem interferir com o sistema imune de maneira distinta, com variações na patogenicidade, na tendência ao encistamento nos tecidos e na indução de resposta inflamatória à infecção. O T. gondii pode se distribuir em três principais linhagens genéticas: tipos I, II e III.
As cepas do tipo I são muito virulentas, com grande capacidade de proliferação e migração através de membranas epiteliais. Estão também associadas a uma maior resposta pró-inflamatória e a uma inibição dos mecanismos parasiticidas do hospedeiro. Já as cepas dos tipos II e III são menos virulentas, induzindo mecanismos de resistência no hospedeiro, com maior tendência a diferenciação em bradizoítos, encistamento nos tecidos e estabelecimento da infecção crônica.
Além dos tipos I, II e III, classicamente descritos na Europa e na América do Norte, genótipos recombinantes (mistos) e atípicos do T. gondii têm sido crescentemente observados nas Américas. Especialmente no Brasil, esses genótipos parecem se assemelhar àquele do tipo I, sabidamente mais patogênico. Na Europa e na América do Norte, predominam os genótipos III e II, nessa ordem, nas infecções humanas.
A via vertical foi a primeira a ser reconhecida como transmissora da toxoplasmose em humanos. Quando uma mulher soronegativa se infecta durante a gestação, parasitas presentes no sangue materno podem atingir a circulação fetal, após atravessarem a placenta. Apesar de o risco de transmissão transplacentária ser menor quando a gestante se infecta no início da gravidez, nessa fase a repercussão da infecção fetal é potencialmente mais grave, em um espectro que se estende desde má-formação profunda que pode levar ao aborto até quadros sistêmicos e neurológicos graves, com retardo mental e cegueira.
Quando contraída no final da gestação, a toxoplasmose impõe maior risco de infecção do concepto, embora com conseqüências potencialmente menos graves, muitas vezes inaparentes por muitos anos. O diagnóstico precoce da soroconversão materna e da infecção fetal é altamente desejável, já que o tratamento diminui não só o risco de transmissão, mas parece reduzir também o número e a gravidade de seqüelas precoces e tardias, principalmente se iniciado dentro dos três primeiros meses após a soroconversão.
A incidência global da toxoplasmose congênita é relatada como variando de 1 a 10 casos para cada 10 mil nascidos vivos. No Brasil há poucos estudos nesse sentido, com incidências variando de 3 a 20 casos por 10 mil nascidos vivos. Recentemente, um estudo multidisciplinar realizado na Universidade Federal de Minas Gerais, baseado na triagem neonatal de mais de 150 mil recém-nascidos em todo o estado, através da detecção de IgM específica no Teste do Pezinho, tem preliminarmente apontado incidência de toxoplasmose congênita em cerca de 1 em cada mil nascidos vivos.
Vem sendo percebida uma correlação inversa entre a incidência de toxoplasmose congênita e o índice de desenvolvimento humano (IDH, preconizado pela Organização Mundial da Saúde) das macrorregiões estudadas. Assim, áreas mais pobres (com menor IDH) têm mostrado taxas de incidência de até 1/500, enquanto em áreas mais favorecidas socioeconomicamente a incidência tem se revelado sensivelmente menor (até 1/3.000). A grande maioria dessas crianças não havia tido a infecção suspeitada previamente, também não tendo havido detecção da soroconversão materna.
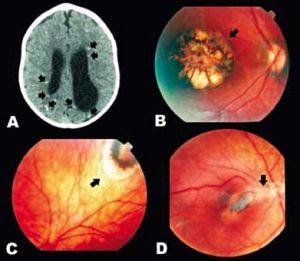
A maioria dos neonatos infectados é assintomática ao nascimento. As manifestações clínicas podem se apresentar logo ao nascimento, ou mesmo ao longo do crescimento da criança. O envolvimento sistêmico grave, com anemia, trombocitopenia, icterícia, rash cutâneo, hepatoesplenomegalia, pneumonia, encefalite e mesmo miocardite pode levar à morte neonatal. A clássica tétrade de Sabin, caracterizada por hidrocefalia ou microcefalia, calcificações intracranianas (Figura 2A), retardo psicomotor e retinocoroidite, é observada em apenas 10% a 15% dos recém-nascidos com infecção.
Diagnóstico
Tanto precoce quanto tardiamente, a retinocoroidite é a principal manifestação da toxoplasmose congênita. Ocorre em 20% a 72% dos infectados ao nascimento e pode se desenvolver em até 90% deles até a adolescência. A região maculodiscal é acometida na maioria dos casos. Entretanto, lesões periféricas podem passar despercebidas num primeiro exame, por vezes sendo descritas de forma errônea como “lesões novas”, numa avaliação subseqüente.
A lesão clássica de retinocoroidite na toxoplasmose congênita é a cicatriz em “roda de carroça” ou rosácea, localizada na mácula, com profunda destruição tissular em sua porção central, pigmentação de suas margens e alguma distribuição centrípeta de pigmento (Figura 2B). Outras cicatrizes retinocoroideanas hiper e/ou hipopigmentadas podem ser encontradas em qualquer outra área da retina central ou periférica (Figura 2C). As lesões atróficas, num exame inicial, podem evoluir para cicatrizes típicas com o passar do tempo. Em alguns casos, observa-se a trave vítrea ligando a lesão ao disco óptico (sinal de Franceschetti) (Figura 2D) ou mesmo a outras lesões.
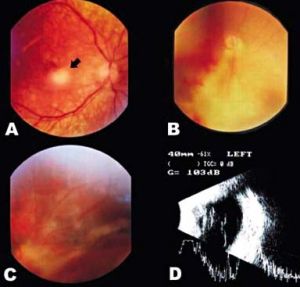
Lesões de retinocoroidite em atividade (Figura 3A), com edema, embainhamento vascular e hemorragia também podem ser encontradas, particularmente no exame precoce desses recém-nascidos. Em alguns casos, o envolvimento inflamatório da retina e coróide pode ser particularmente extenso, simulando quadro de necrose retiniana aguda (Figura 3B). Curiosamente, nesses casos o corpo vítreo se encontra relativamente transparente, apesar da intensa reação inflamatória. Mais raramente, pode haver catarata, traves vítreas mais extensas (Figura 3C), descolamento tracional de retina (Figura 3D) e mesmo microftalmia. Muitos desses recém-nascidos com acometimento ocular grave desenvolvem estrabismo e nistagmo.
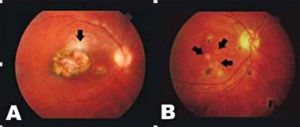
A reativação da retinocoroidite pode ocorrer em qualquer momento da vida, seja como lesão exsudativa focal, satélite (considerada o padrão ouro na toxoplasmose ocular) – Figura 4A, ou através de formas de apresentação atípicas (como a forma punctata externa) – Figura 4B. Cistos de T. gondii podem ser encontrados até mesmo em retinas estruturalmente (e, portanto, oftalmoscopicamente) normais.
Apesar de geralmente autolimitados, sucessivos episódios de recidivas, recorrências da retinocoroidite, podem levar a catarata, glaucoma, opacidades vítreas persistentes, cicatrizes retinocoroideanas extensas, membranas epirretinianas, edema cístico de mácula, buraco macular, descolamento da retina, oclusões vasculares, hemorragia vítrea, neovascularização do disco óptico ou da retina, atrofia óptica e mesmo phthisis bulbi.
Além da investigação epidemiológica e clínica, outras linhas interessantes do estudo da UFMG estão sendo conduzidas, uma envolvendo a avaliação do perfil imunológico da mãe e do feto, e outra investigando os tipos de cepas de T. gondii envolvidos nessas infecções. Crescente importância tem sido conferida à suscetibilidade do indivíduo e à virulência do parasita no pleomorfismo clínico da toxoplasmose.
Tratamento
É preconizado o tratamento de toda criança com diagnóstico de toxoplasmose congênita, durante o primeiro ano de vida, independentemente da existência ou não de sintomas. Apesar de uma meta-análise de coortes européias ter recentemente questionado a eficácia desse tratamento na redução da incidência de seqüelas tardias (principalmente a retinocoroidite), ainda não há dados que justifiquem a mudança da conduta em relação ao tratamento dessas crianças, recomendada pela maioria dos especialistas.
Infelizmente, no Brasil, muitos casos de toxoplasmose congênita ainda são tardiamente identificados, no momento em que grande parte das seqüelas já está estabelecida. A abordagem pré-natal da soroconversão materna não tem sido feita de forma plenamente sistematizada. O Ministério da Saúde recomenda investigação sorológica para toxoplasmose das gestantes sempre que possível. Na prática, muitas se submetem ao teste no início da gravidez, nem sempre efetivamente recebendo as orientações sobre medidas preventivas (Quadro 1) e tampouco repetindo o teste sorológico regularmente até o final da gravidez. Em alguns estados do Brasil, a recomendação é de um teste a cada trimestre. Em contraste, na França, toda gestante soronegativa se submete ao exame sorológico mensal para toxoplasmose.
Diante do potencial de seqüelas, principalmente oculares, da toxoplasmose congênita, é fundamental que toda a sociedade se conscientize de sua importância e da necessidade de atenção especial a essa doença, no diagnóstico, tratamento e, sobretudo, na prevenção.
Principais recomendações higienodietéticas a gestantes suscetíveis à toxoplasmose
• Ingerir água somente filtrada ou fervida.
• Evitar ingestão de carnes cruas ou malcozidas.
• Lavar frutas, verduras e legumes com água filtrada ou fervida antes do consumo.
• Usar luvas e lavar as mãos e utensílios após manipular carne crua ou terra de jardim.
• Evitar contato com felinos e suas fezes, mesmo no lixo ou no solo.
Agradecimentos: À Professora Gláucia M. Queiroz Andrade, professora do Departamento de Pediatria e coordenadora do estudo da UFMG, pela gentil revisão do manuscrito. Ao Dr. Breno Teixeira Lino, do Hospital São Geraldo / HC-UFMG, pela esmerada realização dos exames de ecografia ocular das crianças.
Fernando Oréfice1Doutor em Oftalmologia pela UFMG
Professor Titular de Oftalmologia da UFMG
Diretor da Divisão de Uveítes do Centro Brasileiro de Ciências Visuais
Daniel Vítor Vasconcelos-Santos
Doutor em Oftalmologia pela UFMG
Pesquisador do Núcleo de Ações e Pesquisa em Apoio Diagnóstico – NUPAD-FM/UFMG
Médico Colaborador da Divisão de Uveítes do Centro Brasileiro de Ciências Visuais
Assistente do Serviço de Uveítes do Hospital São Geraldo / HC-UFMG